◆EWTOPIA75試験
高LDLコレステロール血症を有するハイリスク高齢患者(75歳以上)に対する
エゼチミブの脳心血管イベント発症抑制効果に関する多施設無作為化比較試験
Ezetimibe Lipid LoWering Trial On PreventIon of Atherosclerosis in 75 or Older
エゼチミブの脳心血管イベント発症抑制効果に関する多施設無作為化比較試験
Ezetimibe Lipid LoWering Trial On PreventIon of Atherosclerosis in 75 or Older
#1 目的
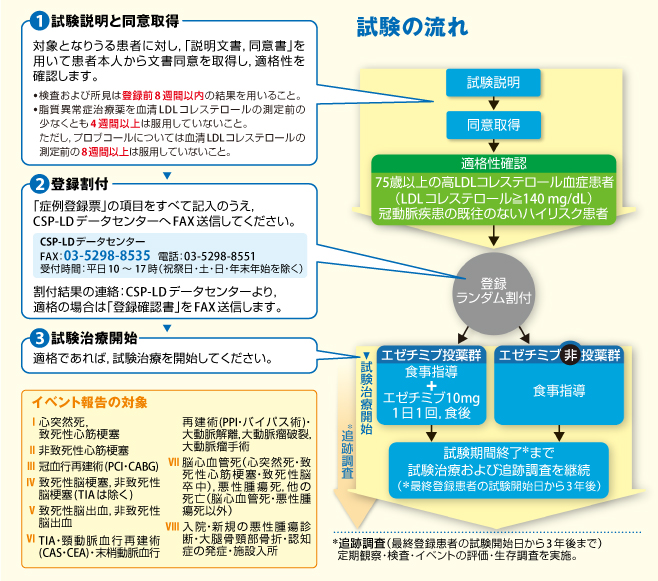
高LDLコレステロール血症を有する高齢患者(75歳以上)で、冠動脈疾患の既往のないハイリスク患者に対して、エゼチミブの脳心血管イベント抑制効果を検討すること。#2 対象
(1)対象選択基準●75歳以上の外来通院可能な高LDLコレステロール血症患者(血清LDLコレステロールが140mg/dL以上)
●脂質以上症治療約は血清LDL-Cの測定前の少なくとも4週間以上、プロブコールについては8週間以上服用していないこと。
↓↓↓ 以下の条件のうち、少なくともどれか一つをみたすもの。
| 1. | 糖尿病 (空腹時血糖値126mg/dl以上 または 随時血糖値200mg/dl以上 または 糖尿病治療薬による薬物治療中) |
| 2. | 高血圧 (収縮期血圧140mmHg以上 または 拡張期血圧90mmHg以上 または 高血圧治療薬による薬物治療中) |
| 3. | 低HDL-コレステロール血症 (HDL-C40mg/dl未満) |
| 4. | 高トリグリセリド血症 (血中TG(空腹時)150mg/dl以上) |
| 5. | 喫煙 (現在喫煙している。既喫煙者は当てはまらない) |
| 6. | 脳梗塞の既往(無症候性は除く) (発症から6ヶ月未満の場合は除外) |
| 7. | 末梢動脈疾患 (ABPI 0.9以下 または 末梢動脈血行再建術の既往歴を有する。) |
(2)除外基準
| × | 血中トリグリセリド(空腹時)400 mg/dL以上 |
| × | 心筋梗塞の既往歴がある |
| × | 冠血行再建術(PCIまたはCABG)の既往歴がある |
| × | 治療が必要な狭心症 |
| × | 脳卒中(脳梗塞および脳出血)発症後6ヶ月未満である |
| × |
重度の肝障害を有する (AST 100 IU/L以上 または ALT 100 IU/L以上 または 肝硬変と診断されている) |
| × | 重度の腎障害を有する (血清クレアチニン値3.0 mg/dL以上) |
| × | 悪性腫瘍と診断されている(既往5年未満不適) |
| × | 認知症と診断されている |
| × | 家族性高コレステロール血症と診断されている |
| × | 心房細動と診断されている(発作性の既往不適) |
| × | エゼチミブに対する過敏症を有する |
| × | 他の治験に参加中である |
| × |
その他,本臨床試験の参加を不適格と担当医師が判断した場合。 (治療中の甲状腺機能低下症、ネフローゼ症候群を有する場合は除外) |
#3 試験計画
(1)試験デザイン多施設共同,前向き,ランダム化,オープン,評価者盲検(Prospective, Randomized, Open-label, Blinded-Endpoint,PROBE)試験
(2)試験治療
#投薬群:食事指導+エゼチミブ10mg/日
#非投薬群:食事指導
の2群のどちらかに無作為化割付けをおこない、エンドポイントについて追跡調査をおこない比較検討する。
| #目標症例数 |
|---|
|
投薬群:3000例、非投薬群:3000例の計6000例 |
| #割付け調整因子 |
|
施設 (各施設) 年齢 (75-79歳 / 80-84歳 / 85歳以上) 性別 (男 / 女) LDLコレステロール(計算) (140-159 mg/dL / 160-179 mg/dL / 180mg/dL以上) |
| #食事指導 |
| 食事指導は,「日本動脈硬化学会動脈硬化性疾患予防ガイドライン2007」のステップ1に基づき各担当医師が行う |
| #併用制限薬 |
| 治療上やむをえないと担当医師が判断した場合を除いて,原則としてエゼチミブ以外の脂質異常治療薬は使用しない。他の併存疾患に対する治療は,十分に行う。 |
#4 エンドポイント
(1)主要評価項目複合脳心血管イベント (心突然死、致死性ならびに非致死性心筋梗塞、冠血行再建術、致死性ならびに非致死性脳卒中)
(2)副次評価項目
各種心血管イベント、各種脳血管イベント、死亡、入院、悪性腫瘍、認知症発症、大腿骨頸部骨折、ADL、施設入所、経済効果
#5 研究期間
登録期間:2009年1月より2014年12月まで追跡調査終了時:最終登録症例の試験開始から3年後(2017年12月終了)
追跡期間:2009年1月より追跡調査終了時まで